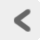4 伝達
ここまで活動電位の伝導というニューロン内部の現象について説明してきた。 しかし当然、 これだけでは脳内における情報処理の生理学的機構を説明したことにはならない。 というのも平均して1400mlの容積を占めるヒトの脳のなかには、 個数にしておよそ1000億個もの神経細胞がつまっているのである。 人間の脳のはたらきを知るためには、 これらのニューロン同士の情報伝達の方法を知る必要がある。 本節では、 軸索を伝導されてきた活動電位が、 どうやって次のニューロンに伝えられるのかを説明していく。
4.1 シナプス
もう一度Figure 2を見てほしい。 ひとつのニューロンから伸びた軸索は、 その端(軸索末端)で他のニューロンと接している。 図には描かれていないが、 軸索はその途中で軸索側枝 axon collateral と呼ばれるたくさんの分枝を出して分かれている。 そしてそれらの分枝の末端(軸索末端 axon terminal) がそれぞれ次のニューロンと接する。 この軸索末端と次のニューロンとの接合部をシナプス synapseといった (Figure 19)。
狭義のシナプスは神経細胞と神経細胞の接合部である。 しかし神経系のもっとも本質的機能は、感覚系から受けた入力を処理し、 運動系によって自己の行動へと反映させることである。 この目的を達成するには、 ニューロンはそれら他のシステムを構成する細胞(感覚細胞・筋細胞・腺細胞) とも連絡をする必要がある。 こうしたニューロンとニューロン以外の細胞の連絡も、 一般にシナプスとよばれることが多い。 さらには、例えば網膜の視細胞と双極細胞のように、 ニューロン以外の細胞同士でニューロンと同様の細胞間シグナル伝達機構が存在する場合もあり、 これもシナプスに含められることがある(広義のシナプス)。 このようにシナプスという用語の定義にはある程度ゆらぎが存在し、 それが指示する対象は文献によってまちまちである。 たとえば神経筋接合部(ニューロンと筋細胞の連絡部分) を何の断りもなくシナプスと呼ぶ教科書もあれば、 神経筋接合部はシナプスと呼ぶべきではないと明記している本もある。 このあたりは慣れの問題なので、 シナプスということばは文脈に合わせて柔軟に理解するようにしておくとよいだろう。
さて、Figure 19に戻ってシナプスの構造的解説を続けよう。 シナプスにおける軸索末端側は、 情報が伝えられる向きからいうと「前」側なので シナプス前 presynapseと呼ばれる。 逆にその情報を受け取る側のニューロンは「後」側であるから、 これをシナプス後 postsynapseと表現する。 シナプスはニューロン同士の「接合部」とはいうものの、 本当に膜と膜がくっついているわけではない。 一般的なシナプスではシナプス前・後の細胞膜 (シナプス前膜 presynaptic membraneと シナプス後膜 postsynaptic membrane、 シナプス後膜はシナプス下膜 subsynaptic membrane ともいう)のあいだに20nmほどのすきまが開いている。 これをシナプス間隙 synapse cleftという。 シナプスは通常次のニューロンの樹状突起や細胞体に形成されるが、 他のシナプスのシナプス前側(軸索末端部)や軸索の途中などへ形成されるシナプスもある。
神経系におけるシナプスでは、 伸びてきた軸索の末端が小さなコブ状にふくらみ、 次のニューロンへとくっついている。 これをシナプスボタン synapse boutonという。 ここでの「ボタン」は洋服などのボタン(button)のことではなく、 「こぶ」を意味する解剖学用語(bouton)である。 英語の発音としては「ぶーたん」に近くなる。 軸索末端というのは文字通り軸索の終末部一般を指す用語であるのに対して、 シナプスボタンは軸索末端部の「ぽっち」という物理構造を指している。 筋収縮の運動生理などに詳しいかたは、 軸索終末が大きく広がって終板 end-plateという構造をつくり、 シナプス後にも接合部ひだ junctional fold というひだ状の構造があることを知っているかもしれない。 しかしこれらの構造は神経筋接合部に特有のもので、 ニューロン同士がつくるシナプスではみられない。
4.2 伝達の軸索末端過程
構造的な話はこれぐらいにして、 シナプスの機能に関する説明をしていこう。
シナプスにおけるシナプス前ニューロンからシナプス後ニューロンへの情報の受け渡しを 伝達 transmissionという。 この2細胞をまたぐ伝達の過程は、 そう簡単ではない。 シナプス前膜と後膜を隔てる間隙は約20nmにおよび、 ここには細胞外の基質が存在している。 そのためシナプス前ニューロンから後ニューロンへと、 伝導のように電流や電位変化を直接伝えようとしても、 瞬時に細胞外基質中へと拡散してしまう。 そのためシナプス伝達においては伝導のような電気的信号は使えない。 そこで伝達では、電気に変わって化学物質を用いた情報伝達が行なわれている。 すなわちシナプス前ニューロンの軸索末端から化学物質がシナプス間隙へと分泌され、 それをシナプス後膜が感知して、 シナプス後ニューロンに新たな活動電位が発生するのである。 以下この過程について順を追ってみていくことにしよう。
活動電位はシナプス前ニューロンの軸索を伝わり、 軸索末端へと到達する。 軸索末端の細胞膜上にも軸索膜と同様に電位依存性の Na+チャネルやK+チャネルがあるが、 それに加えて 電位依存性Ca2+チャネル voltage-dependent calcium channel が存在することが特徴である。 軸索末端における電位依存性Ca2+チャネルは、 シナプス間隙に接するシナプス前膜上に局在している。 Table 1には挙げなかったが、 一般にCa2+は細胞内より細胞外の濃度が圧倒的に高い。 よって軸索末端への活動電位の到達による電位変化で電位依存性Ca2+チャネルが開口すると、 細胞外から細胞内へとCa2+が流入する。 ここまでは伝導の節で学習した電位依存性Na+チャネルの仕組みと変わらない。 しかし軸索はここで終わっているのだから、 「Ca2+流入による活動電位発生でその隣のチャネルが開いて…」 というように、 さらに伝導が続いていったりはしない。 すなわちCa2+は、 伝導において細胞内へ流入するNa+のような電気的信号の媒体として (次の活動電位を発生するために)はたらいているのではない。 軸索末端におけるCa2+はむしろ化学的な信号として作用する。 Ca2+流入により Ca2+をスイッチとした諸々の分子による化学反応カスケードが進行し、 最終的にはシナプス前膜からシナプス間隙への化学物質の分泌が起こるのである。
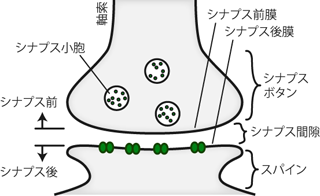
シナプス前の軸索末端部には、 分泌するための化学物質が袋状の細胞内器官に蓄えられている。 これをシナプス小胞 synaptic vesicleという。 伝達のための化学物質の放出は、 シナプス小胞がシナプス前膜と結合することで、 その内部に蓄えた物質を細胞外へとまき散らすかたちで生じる。 これを開口分泌 exocytosis (エクソサイトーシス)という(Figure 20)。 これは神経系に限らず、さまざまな消化器官や腺器官においてみられる細胞の一般的な分泌様式である。 そしてニューロン間のシナプス伝達においても、 この開口分泌機構によって化学物質をシナプス間隙へと放出することが情報伝達の第一歩となる。 シナプス小胞から放出される化学物質は「神経の伝達を担う物質」であるので 神経伝達物質 neurotransmitter、 あるいは単に伝達物質 transmitterと呼ばれる。
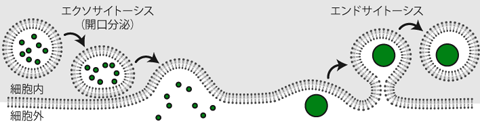
シナプスにおける開口分泌は、詳しくみると、 シナプス前膜への小胞の付着 dockingと、 小胞の細胞膜への融合 fusion というふたつのプロセスからなる(Figure 21)。 このうちCa2+の流入が駆動するのは、 後者の融合の過程である。 軸索末端において、 シナプス小胞はシナプス前膜に細胞内から付着した状態で待機している。 そこへ活動電位が到達することで、 電位依存性のCa2+流入が生じ、 Ca2+濃度の上昇をスイッチとした小胞の融合プロセスが進行して、 シナプス間隙に小胞内の化学物質が放出されるのだ。 このとき、シナプス前膜において小胞が付着した状態で「ストック」 されている箇所を放出活性帯 active zoneと呼ぶ。
じつはシナプス前の軸索末端部における開口分泌の分子過程は、 現在でも活発に研究がなされている分野だ。 最新の研究により、 伝達物質の放出を制御する種々のタンパク分子が明らかにされつつある。 そのため本項では、 開口分泌を担う分子メカニズムの詳細には踏み込まない。
4.3 伝達物質の受容
さて、こうして放出された神経伝達物質は、 このあとどうやって次のニューロンに効果を及ぼすのか。 前節で学習した伝導においては、 近隣で生じた電位変化を検知してはたらく電位依存性のチャネルがはたらいていた。 シナプス伝達では、 電位に代わって化学物質が投げかけられた。 よって、化学物質を検知してはたらく分子的機構が必要となる。
Figure 22は、 シナプス後膜に存在するそのようなタンパク分子の一例である。 このタンパクは化学物質作動性イオンチャネル ligand-gated ion channel (化学物質依存性イオンチャネル ligand-sensitive ion channel) と呼ばれるチャネルだ。 イオンチャネルと名が付くとおり、 このタンパクは前出のチャネルタンパクと同様、 開口することで本来は細胞膜を通り抜けることのできないイオンを透過させることができる。 たとえばFigure 22に挙げたアセチルコリン作動性チャネルは、 これまで登場したチャネル類ほどイオン選択性が強くなく、 Na+・K+・Ca2+などの陽イオンを比較的幅広く通す。 しかしこのチャネルを介したこれらのイオン種の移動は、 総和としては細胞内への陽電荷の流入、 すなわち膜の脱分極を引き起こす。 このようなシナプス後に電位変化をもたらすチャネルの開閉が、 細胞外基質におけるアセチルコリンという分子の有無によって制御されているのだ。 アセチルコリンは、 高等学校の生物学でも登場する、 有名な神経伝達物質のひとつである。
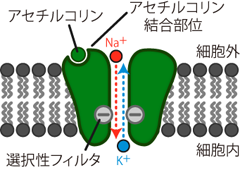
いま、シナプス後膜上にアセチルコリン作動性チャネルが存在するとき、 シナプス前からアセチルコリンが分泌されたとしよう。 アセチルコリンは細胞外液中を拡散し、 シナプス後膜へと届いてアセチルコリン作動性チャネルの細胞外部位と結合する。 するとチャネルが開口し、 細胞内へのNa+流入を引き起こしてシナプス後ニューロンを脱分極させる。 このようにしてシナプス後膜に脱分極生じる電位変化を 興奮性シナプス後電位 excitatory postsynaptic potential (EPSP)とよぶ。 興奮性 excitatoryとは「膜を興奮させる」 という意味だから、 EPSPはシナプス後ニューロンの電位を活動電位を発生させる方向へ変化させる シナプス伝達である。
一方、化学物質作動性イオンチャネルのなかには、 Na+ではなくK+やCl-を通すものもある。 そのようなチャネルがシナプス後膜で開口した場合、 細胞内からのK+流出や細胞内へのCl-流入が起こりシナプス後膜は過分極する。 これによりシナプス後ニューロンは閾値に達しづらくなり、 活動電位の発生(ニューロンの発火)が抑えられる。 このような電位変化を抑制性 inhibitoryと表現し、 このときシナプス後膜に生じた過分極性の電位変化を 抑制性シナプス後電位 inhibitory postsynaptic potential (IPSP)とよぶ。 ちなみに興奮性か抑制性かを問題とせず、 単に伝達によってシナプス後膜に生じた電位変化を指したい場合には、 シナプス後電位 postsynaptic potential (PSP)という表現も用いられる。 先ごろ出荷終了が発表された某携帯ゲーム機のことではない(2014年6月9日現在)。
このようにシナプス後膜では、 化学物質作動性のチャネルタンパクが、 細胞外から与えられた化学物質を検知して、 細胞内の電位変化へと変換している。 これによりニューロンは、 シナプス間隙によって物理的に隔たれた他のニューロンからの情報伝達を受け取ることができる。 ちなみにシナプス後膜には、 化学物質シグナルを受容するためのタンパク分子が多量に存在するため、 シナプス後膜は一般に周辺の細胞膜よりぶ厚くなっている。 これをシナプス後肥厚 postsynaptic densityとよぶ。 また中枢神経系のシナプスにおいては、 シナプス後膜がシナプス後細胞の樹状突起や細胞体から少し突出し、 トゲのような構造をつくっている場合がある。 これをスパイン spine(棘突起, シナプス棘)という。 スパインはシナプス後における細胞内シグナル伝達を空間的に制限する機能をもつと考えられており、 分子細胞レベルの化学応答と行動レベルでの神経系の機能(記憶・学習メカニズムなど) を結びつける生物学的構造として注目されている。 初学者のかたにおかれては、 スパイク(ニューロンの発火のこと)とスパイン(シナプス後の微小細胞構造) を混同しないよう注意されたい。
コラム3: Cl-チャネルと「抑制性」
先にほど、 シナプス後ニューロンにIPSPを生じうる化学物質作動性イオンチャネルとしてCl-チャネルを挙げた。 その理由は、Cl-が細胞内より外に多く、 チャネルの開口により負電荷をもったCl-が細胞内に流入してくるからだった。 しかしよく考えてほしい。 濃度勾配だけでそう簡単に決め付けていいのだろうか。
わたしたちは第1節で、 細胞内外のイオン濃度からそのイオンの平衡電位を求めるネルンスト式を学習した。 この式によって得られるCl-の平衡電位を思い出してみよう。 Table 2によれば、 その値は-67mVである。 さて、静止膜電位の値は(細胞によって多少の差はあるが)およそ-75〜-60mVである。 よってニューロンの静止膜電位がCl-の平衡電位を下回っている(-67mVより低い)ということは、 別に珍しいことではない。 このようなときCl-を透過するチャネルが開口すると、どうなるだろうか。 濃度勾配にしたがってCl-が細胞内に流入しようとする力以上に、 細胞内の負電荷がCl-を細胞外へ強く押し出し、 差し引きではCl-は細胞外へ流出する。 つまり静止膜電位が-67mV以下のニューロンにおいては、 Cl-の開口は膜電位を上げる方向にはたらくのだ。 このような効果をもちうる化学物質作動性Cl-チャネルを「抑制性」といってよいのだろうか。
答は「いってよい」のである。 確かにCl-の平衡電位より低い膜電位を持つニューロンでは、 Cl-チャネルの開口はCl-の流出を引き起こし、 結果膜電位は上昇する。 しかしそれによって細胞がCl-の平衡電位(-67mV)に達したとしても、 Cl-はそれ以上の膜電位上昇をもたらしはしない。 ひとたび平衡電位に達してしまえば、 電気的駆動力と化学的駆動力が釣り合い、 Cl-は(見かけ上)流入出しなくなるからである。 そしてもしニューロンがそれ以上に電位上昇しようとしたら、 今度はCl-が細胞内に流入し、 それを妨げる方向に作用するだろう。
つまりCl-チャネルは、 細胞の電位が(Cl-の平衡電位より低い状態から) Cl-の平衡電位に達するまでは、 膜電位を上昇させる方向にはたらくかもしれない。 しかし細胞がCl-の平衡電位(-67mV)を通りこして脱分極し、 電位依存性Na+チャネルの閾値に近づこうとするのは妨げる。 ニューロンの活動とはすなわち電位依存性Na+チャネルによって活動電位が起こることだから、 Cl-チャネルの開口は、 場合によっては膜を脱分極させるとはいえ、 やはり抑制性(ニューロンを発火させない方向に機能する)というべきなのだ。
このように、 チャネルの開口によってあるイオンの透過性が高まることの効果は、 単に「マイナスのイオンを流入させるから抑制性」という安直なまる覚えではなく、 むしろ「膜電位をそのイオンの平衡電位につなぎとめておこうとする力の強まり」 として理解すべきである。 イオンの膜透過性上昇はゴールドマンの式においては透過係数の増大として表現されるので、 透過性が増大すれば、 そのイオンの平衡電位の膜電位に対する寄与が強くなることがわかる。
4.4 古典的伝達物質
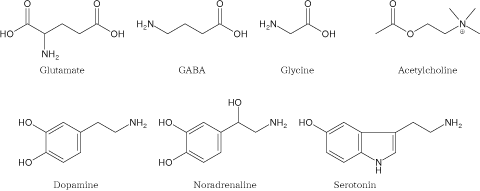
開口分泌によってシナプス間隙に放出される神経伝達物質には、 さまざまな化学種が存在する。 本項ではそれらの伝達物質たちを簡単に紹介しておきたい(Figure 23)。
前項において、 EPSP(興奮性シナプス後電位)をもたらす化学物質作動性チャネルの代表例として、 アセチルコリン性のチャネルをあげた。 アセチルコリンは、 神経筋接合部や自律神経終末ではたらく伝達物質として高校生物で習うので、 かなりよく知られた神経伝達物質といえるだろう。 また高校生物の神経系の範囲でいえば、 交感性と副交感性の自律神経において、 使われる伝達物質が ノルアドレナリンとアセチルコリンとで異なっている、 というのがお決まりの暗記項目だった記憶がある。
これらの印象が強いと、 神経伝達物質といえばアセチルコリンやノルアドレナリンだという認識をもってしまっているかもしれない。 たしかにこれらの物質は、実際に脳のなかでもはたらいている重要な伝達物質である。 しかし実際の脳のなかを覗いたとき、 もっとも多く使われている神経伝達物質はグルタミン酸 glutamateである。 グルタミン酸はアミノ酸の一種であるが、 神経系においては軸索末端のシナプス小胞内に蓄えられ、 活動電位の到達によってシナプス間隙へと放出される神経伝達物質としてはたらく。 シナプス後においてこれを受容するグルタミン酸作動性チャネルは、 チャネルの開口によって脱分極を引き起こすため、 グルタミン酸は 興奮性伝達物質 excitatory transmitterと呼ばれる。
一方、グルタミン酸とよく似た化学構造をもちながら、 伝達物質としてはまったく逆の役割をもつのが γ-アミノ酪酸 gamma-aminobutyric acid(GABA)だ。 シナプスにおいてGABAが放出されると、 シナプス後膜のK+やCl-の透過性が高まり、 結果としてシナプス後ニューロンは発火しにくくなる。 このためGABAは 抑制性伝達物質 inhibitory transmitterと呼ばれる。 同じくアミノ酸の一種であるグリシン glycineも、 抑制性の伝達物質としてはたらく。 GABAが中枢神経系のさまざまな部位ではたらいているのに対し、 グリシン受容体は大脳皮質にはほとんど存在せず、 おもに脳幹や脊髄ではたらいている。
このように神経系においては、 代謝やタンパク合成といったいわゆる栄養のためのアミノ酸とはべつに、 一部のアミノ酸を神経伝達物質として利用している。 (「なぜ栄養素を伝達物質に使うのか?」 「なぜ数あるアミノ酸のなかでグルタミン酸なのか?」 という疑問は非常に興味深い問いだが、 これは生物進化の妙として結果的にこうなっているとしかいいようがなく、 科学的に明確な答を出すのは難しい。) しかし、神経系ではたらく伝達物質はアミノ酸だけなのかといえば、 それは違う。 たとえば高校生物でおなじみの ノルアドレナリン noradrenaline(NAまたは ノルエピネフリン norepinephrine,NE)はアミノ酸ではないが、 神経伝達物質として作用する。 ノルアドレナリンとよく似た化学構造をもつ ドーパミン dopamine(DA)や セロトニン serotonin(5-HT)も神経伝達物質である。 セロトニンの略称は、 化学化合物としての名称(5-ヒドロキシトリプタミン 5-hydroxytryptamine)に基づいている。 また免疫系ではアレルギーの介在物質として悪名高い ヒスタミン histamineも、 神経系においてはマイナーながらはたらく伝達物質である。 これらの伝達物質はいずれもアミノ基を1つ有し、 アミンという化学物質に属するため、 「アミン型」の伝達物質, モノアミン monoamine(アミノ基を1つだけもつアミン), 生体アミン bioamineなど、 さまざまな呼ばれかたをしている。 またセロトニン以外の分子は、 ベンゼン環の隣接した2ヶ所(オルト位)に水酸基をもつカテコールという化合物でもあるので、 カテコールアミン catecholamine(カテコラミン)とも呼ばれる。
こうした生体アミン類は、 先のアミノ酸型の伝達物質と違い、 一概に「興奮性/抑制性伝達物質」といった呼ばれかたをすることは少ない。 というのも、これらの物質が受容細胞へ与える影響は、 イオンチャネルの開閉による瞬間的な電位変化といった単純な応答にとどまらないからだ。 たとえばあるニューロンにモノアミン性の伝達物質が作用した結果、 シナプス後の膜電位はその時点では変化しないのに、 次に別のシナプスからの入力がきたときに生じる電位変化量が変わったりする。 またこれらの物質を受け取るシナプス後側の膜タンパクには多くの種類が存在し、 どのタンパク分子が伝達に関与するかによって、 同じ伝達物質でもシナプス後ニューロンに与える影響が変わってくる。 たとえば線条体という脳部位のニューロンに作用するドーパミンは、 ある一群のニューロンには興奮性の影響(脱分極)を与えるが、 べつのニューロンたちには抑制性の影響(過分極)をもたらす。 このように、 直接イオンチャネルを開閉して定型的なシナプス後電位を生じさせるのではなく、 より複雑なかたちで膜電位を変化させたり、 場合によっては遺伝子発現などの電位状態以外の細胞の性質にまで影響を与えるシナプス伝達を、 調節性伝達 modulatory transmission あるいは 神経修飾 neuromodulationという。
前項において、 シナプス後膜で伝達物質を受け取るタンパクの例にアセチルコリン作動性チャネルを挙げた。 しかしじつは、 アセチルコリン acetylcholine(ACh) が直接イオンチャネルの開口を引き起こすこの伝達様式は、 神経筋接合部や自律神経節などの末梢においてのみみられる。 神経系の中枢たる脳においては、 アセチルコリンも生体アミン類と同じく、 定型的な電位変化にとどまらない複雑な影響を与える。 言い換えれば、 脳におけるアセチルコリンの伝達物質としての役割は神経修飾である。 アセチルコリンは構造上アミノ酸でもアミンでもなく、 コリンと呼ばれる化学物質だ。 生体内に自然に存在する伝達物質のうちコリンに属するものは、 いまのところアセチルコリンのみしか知られていない。
本項で挙げた伝達物質としてはたらく化学分子は、 いずれも低分子量で、 比較的古くからそのシナプス伝達動態が知られてきた物質である。 これらの伝達物質を、 古典的伝達物質 classical transmitterという。
4.5 神経ペプチド
グルタミン酸やアセチルコリンなどを「古典的」と呼ぶからには、 「ニューな(死語)」伝達物質があるのだろう。 それは数個から数十個のアミノ酸が鎖状につながった、ペプチドである。 近年、 アミノ酸・生体アミン・コリンのほかに、 種々のペプチド分子が伝達物質としてはたらいていることがわかってきたのだ。 こうしたペプチドのことを神経ペプチド neuropeptideという (Figure 24)。
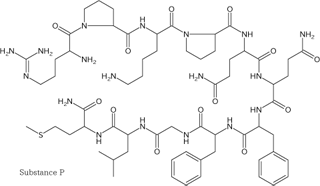
11アミノ残基と比較的短いP物質でさえ、 古典的伝達物質と比較すると化学構造は複雑になる。
ペプチドとは定義上「複雑な立体構造をもたない短いタンパク」を指すから、 神経ペプチドも少数(たいていは50個以下)のアミノ酸が連なったものである。 とはいえ、アミノ酸単体や、 それに準ずる小分子であった古典的伝達物質と比べると、 ペプチドというのは相当に大きな分子といえる。 これらの神経ペプチドは、 生体アミンやコリンと同じく、 即時的な電位変化にとどまらない多様な修飾をシナプス後に与える。 しかしその効果は分子ごとにさまざまだし、 神経系のなかで使われている場所もまちまちである。 そもそも、神経ペプチドはいまなお次々と新しい分子が発見され続けている。 代表的な分子名を挙げるだけでも、 ダイノルフィン dynorphin・エンドルフィン endorphin・ エンケファリン enkephalinなどのオピオイド opioid類、 P物質 substance P、 神経ペプチドY neuropeptide Y、 ニューロキニン neurokinin、 オキシトシン oxytocin、 オレキシン orexinなど、 なかなか紙面を圧迫してくれる。 これらの分子の機能や発現する脳部位を網羅するのは、 とてもではないが本解説文の手に余る。 今後、こうした物質の名前を見かけたとき 「なんじゃそりゃ」とならないよう、 ざっと名前だけでも眺めておいてもらえれば、と思う。
分子量の大小に基づいて、 伝達物質を小分子の「古典的伝達物質」と 比較的大きい「神経ペプチド」のようにわざわざ二分するというのは、 もしかすると不思議に思われるかもしれない。 しかし両者には、その生合成過程に大きな違いがある。 古典的伝達物質のような小分子の物質は、 材料が軸索末端に蓄えられており、 そこで必要に応じて合成される。 また伝達物質としてシナプス間隙に分泌され、 伝達の役割を終えたあとも、 一旦不活化されるなどの過程を経たうえで、 膜輸送体などを経由してシナプス前ニューロンへと 再取り込み reuptakeされるものが多い。 こうして回収された原材料は、 軸索末端において再度伝達物質へとつくり直され、 以降の伝達のときに再利用されることになる。
しかし神経ペプチドはそうはいかない。 というのも、 これらの分子は曲がりなりにもアミノ酸の連なった小タンパク分子なのだ。 よってその合成には、遺伝子の転写・翻訳が必要となる。 すなわち、 DNAの配列として核内にコードされた神経ペプチドは、 転写によってmRNAへと変換され、 さらにリボソームによって翻訳されてペプチド分子となる。 こうして細胞体でつくられたペプチド分子は、 伝達物質として用いるために、 わざわざ長い軸索のなかを軸索末端まで細胞内輸送される。 そして軸索末端に蓄えられ、 しかるべきときがやってきたら分泌されるのである。 しかも、 小分子の伝達物質ならシナプス間隙から膜タンパクをつかって回収できたが、 比較的大きなペプチド分子は、 一旦細胞外に拡散してしまうと容易に回収できない。 よって神経ペプチドは、 基本的には分泌されたらそれまでで、 周囲の細胞外基質へと拡散されて薄められることでその役割を終える。
4.6 ○○作動性ニューロン
このように、 シナプスにおいてシナプス前からシナプス後へと放出される伝達物質には、 アミノ酸・生体アミン・コリン・神経ペプチドなど、 大小さまざまな分子が存在する。 ただし、個々のニューロンがこれらの伝達物質すべてを細胞内に取り揃えているわけではない。 その一方で、 単一のニューロンはこれらのうちのたったひとつのみしか使えないというわけでもない。 ひとつのニューロンは、 多くの場合、 数ある伝達物質のうちの数種の分子を組み合わせてもっている。 1回のシナプス伝達でも、 単一種の伝達物質だけが放出されるのではなく、 複数の伝達物質が同時に放出され、 シナプス後ニューロンへと情報を伝えている。 これを伝達物質の共放出 co-releaseという。
かつては「ひとつのニューロンはたった一種の決められた伝達物質しか使わない」 という原則が信じられていたこともあった。 しかしこの考えは、現在の知見からは完全に否定されている。 ただし1ニューロンが複数の伝達物質を共放出する場合、 たいていはそのうちの1種が古典的伝達物質で、 残りは神経ペプチドである。 1ニューロンが2種以上の古典的伝達物質を共放出する場合でも、 主たる伝達物質がグルタミン酸かGABAで、 それに加えてアセチルコリンやドーパミンなどの調節性伝達物質を分泌する例が多い。 まあ実際には、GABAとグリシンを共放出するシナプスの例も知られているため、 問題は簡単ではない。 しかし少なくとも、 1ニューロンが1種類の伝達物質しかもっていないという素朴な発想は、 神経系の複雑な情報伝達様式を過小評価した思い込みである。
このように、 単一のニューロンが複数の伝達物質を分泌することはもはや常識である。 その一方で、ニューロン活動の機能に関して議論する際には、 「話題の中心であるそのニューロンはどんな伝達物質を使っている細胞なのか」 を明確にしたいときがある。 たとえば動物が行動をしたとき脳内のニューロンの発火頻度 (単位時間あたりに発する活動電位の数)が増えたとしても、 そのニューロンがグルタミン酸を使う細胞なのかGABAを使う細胞なのかによって、 次のニューロンに与える効果が変わってくる。 このような場合、 ニューロンが主として分泌する伝達物質を 「伝達物質名+作動性ニューロン」という呼称で表わすことがある。 英語では「伝達物質名+ergic」となる。 たとえばグルタミン酸を分泌し次のニューロンを興奮させるニューロンなら グルタミン酸作動性 glutamatergic、 GABAを分泌するならGABA作動性 GABAergicニューロンといえる。 (ちなみにGABAergicの発音は「ぎゃばーじっく」ではなく、 「ぎゃばあーじっく」のように「ば」のあとで「あ」母音を言い直すような発音になる。) あるいはもっと簡単に、 ドーパミンを分泌するニューロンなら「ドーパミンニューロン」のように、 「作動性」を省いて呼ぶこともある。
これはいずれも、 そのニューロンが分泌する伝達物質による呼称である。 おなじ「作動性」でも、 化学物質作動性チャネルにおける「作動性」とは意味が異なるので注意したい。 アセチルコリン作動性チャネル(ACh-gated channel) といったらアセチルコリンを受け取るチャネルタンパクだが、 アセチルコリン作動性ニューロン(AChergic neuron) といったらアセチルコリンを分泌するニューロンである。 英語ではまったく違う単語だ。 某ネット掲示板において 「GABA作動性ニューロンというのはGABAによって作動させられるニューロン、 GABAを受け取るニューロンのことです」 という堂々たる回答がベストアンサーになっていたが、 完全な間違いなので信じてはならない。
繰り返しになるが、こうした呼び方は単に 「そのニューロンがこの伝達物質を使いますよ」ということを表現しているだけだ。 べつに「そのニューロンが使うのはこの伝達物質のみだ(one and only one)」 といっているわけではない。 だから「どこどこの脳領域に存在するグルタミン酸作動性ニューロンはドーパミンも放出するので…」 というような表現には何ら問題がない。
4.7 空間的加重・時間的加重
ひとつのシナプスによって生じるシナプス後電位には、 次のニューロンを一発で発火させるほどの力はない。 1シナプス由来のEPSPは大きくても数mV程度の脱分極引き起こすだけであるし、 同一のニューロンに抑制性のシナプスが結合していた場合、 EPSPがIPSPによって相殺されてしまうからである。 もちろんこれとは逆に、同時に複数のシナプスからEPSPが引き起こされれば、 それが統合 integrationされてより大きな脱分極がシナプス後ニューロンに生じる。 よってあるニューロンが発火するためには、 そのニューロンの細胞体や樹状突起に接続している無数のシナプスからの入力、 すなわちEPSPとIPSPの総和が軸索小丘において閾値以上の脱分極を引き起こす必要がある。
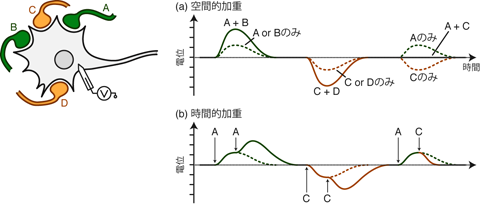
シナプス後ニューロンにおけるEPSP・IPSPの統合に関しては、 2通りの様式が考えられる。 複数のシナプスからの同時的入力が統合されるケースと、 1つのシナプスからの連続した入力が統合されるケースだ。 前者を空間的加重、後者を時間的加重と呼ぶ。
空間的加重 spatial summationとは、 異なるシナプスからのシナプス後電位の足し合わせのことである。 Figure 25aを見てほしい。 この図においてA・Bは興奮性シナプス, C・Dは抑制性シナプスである。 たとえばシナプスA・Bから同時に興奮性の入力があったとき、 シナプス後ニューロンにはA+B分の脱分極が生じる。 抑制性シナプスに関しても同様でC・Dの同時入力によって C+D分の過分極が生じる。 またA(興奮性)とC(抑制性)から同時に入力があれば、 EPSPとIPSPが相殺する。 ただしその相殺の結果、図のように膜電位がまったく静止膜電位から動かないとは限らない。 EPSPとIPSPがちょうど打ち消しあう大きさで生じた場合には膜電位は変化しないだろうし、 そうでなければ相殺しきれなかった分、少し脱分極や過分極が起こるだろう。
各シナプス後電位がシナプス後ニューロンの発火にどれだけ寄与するかは、 おもにそのシナプスがニューロンのどこに付いているかで決まる。 たとえばシナプス後ニューロンの樹状突起の最末端に存在するシナプスで伝達が起きたとしても、 そのPSPは軸索小丘部に伝わるまでにほとんど減衰してしまう。 逆に細胞体に直接ついているシナプスからのPSPはあまり減衰せずに軸索小丘にまで伝わり、 シナプス後ニューロンの発火の可否に大きな影響を与える。 このように異なるシナプスからの入力は、 活動電位のon/offが決まる軸索小丘と各シナプスとの距離により、 その寄与に違いが生じる(Figure 26)。 これは細胞体や樹状突起に生じたPSPが、 軸索での膜興奮のように能動的に再生されることなく、 受動的に細胞内に拡散するからである。
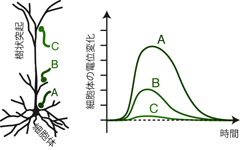
一方時間的加重 temporal summationとは、 ひとつのシナプスから連続で引き起こされたシナプス後電位の足し合わせである。 Figure 25bを見てほしい。 今度の図ではAが興奮性シナプス,Bが抑制性シナプスだ。 いま十分な時間的間隔をおいてAから2回のシナプス伝達が起こっても、 シナプス後ニューロンは普通サイズの脱分極を2回するだけである。 しかしこの2回の伝達の間隔が短くなり、 まだ1回目の脱分極が消えないうちに2回目の伝達があると、 ニューロンはそこからさらに脱分極する。 よってシナプス後ニューロンは 通常の1回分の脱分極よりも大きく電位変化することになる。 もちろんBについても同様で、短い時間間隔で入ってきた抑制性の入力も、 足し合わされてより大きな過分極を引き起こす。 このとき連続する2回の入力のあいだの間隔が短いほど、 シナプス後における加重の結果は、 1回分のPSPよりも大きくなる。 すなわち空間的加重ではシナプスの位置によってPSPが重みつきで加重されたが、 時間的加重においては、 そのシナプスからの入力頻度によって加算時の重みが異なることになる。 あるシナプスからの入力は、 その頻度が高ければ高いほど大きく加重され、 シナプス後ニューロンの発火に対する寄与が増大する。
4.8 シナプス伝達の意義
神経が伝導という非常に速くかつ長距離に情報を伝える手段を持ちながら、 わざわざシナプス伝達のような仕組みをもっているのはなぜだろうか。 シナプス伝達には、 化学物質の放出やそれによるイオンの流入出、 種々の化学変化の過程が必要であり、 伝導に比べてコストの面では非効率なのだ。 またこのような複数の化学反応を含むため、 伝達には1〜2msほどの時間がかかる。 これをシナプス遅延 synaptic delayとよぶ。 よってある場所からある場所まで情報伝達を行なう際、 その途中のシナプスの数が多ければ多いほど時間がかかることになる。 ということはなるべく速く情報伝達をするためには、 目的地まで軸索を伸ばし、伝導を使って一気に伝えるのが一番いいはずなのだ。
しかし実際のニューロンは数多くのシナプスによって他のニューロンと結合しあい、 ときには不必要とさえ思えるほど、 たくさんのシナプスを経由しながら情報を伝えている。 ニューロンは一般にFigure 2のような模式図で描かれるから、 つい1つのニューロンには数個のシナプスしか付いていないイメージを抱きがちだ。 しかし実際の生体ニューロンには、 1細胞に1万を越すシナプスが付いている例も珍しくない。 このことから、 われわれの神経系において、 シナプスがなんらかの重要な役割をもっているのは間違いない。
ではそのシナプスのはたらきとはなんだろうか。 結論からいうと、それはシナプス電位の統合による情報処理だといえる。 すなわちシナプスは単にニューロンとニューロンの間をつなぐだけではなく、 その過程で情報を統合し「整理・判断」しているのだ。 このことを理解するために、 先にみた空間的加重・時間的加重の意義について考えてみよう。 空間的加重とは、 ひとつのニューロンに存在するすべてのシナプスからの入力を、 シナプス位置にしたがって重みつきで加算する過程だった。 一方、時間的加重とは、 各シナプスからの入力をある時間幅で足し合わせることで、 入力頻度の高いシナプスからのPSPの影響が大きくなる過程であった。 ここでこれらを意味的に解釈してみると、 空間的加重・時間的加重はいずれも、 そのニューロンに対する入力を時空間的に重みつきで加算し、 入力の「あり/なし」という2値情報から 「どれだけの量・どれだけの頻度の入力があるか」というアナログ情報を作り出しているといえる。 そしてこのような加重の結果、 軸索小丘において閾値以上の脱分極が起これば、 ニューロンは活動電位を発生して次のニューロンへと信号を発する。 逆に加重の結果が閾値に達しなければ、 いくらそのニューロンに入力があろうとも発火は起こらず、 信号は完全に立ち消えてしまう。
このようにシナプスにおける入力の加重過程は重みつき総和演算の過程であり、 そしてニューロンは、 その演算結果がある値を超えると出力を行なう一種の多数決素子なのである。 このときシナプスからのon/off(1/0)のデジタルな入力が、 シナプス後ニューロンにおいては 入力の数や頻度・軸索小丘までの距離といった要因から重みづけされ、 アナログ量として扱われている点はとくに興味深い。 しかもそのアナログ変化が閾値に達すると、 シナプス後ニューロンは活動電位というかたちで再びデジタル情報を発するのである。 すなわちニューロンは、 情報を減衰させずに伝えたい伝導の過程ではデジタル的な情報表現を利用し、 一方でより細かな情報の統合をもとにして次なる信号を発生するかどうかを決める伝達の過程では、 アナログ的な情報表現を使っているのである。 このような柔軟かつ効率的な情報表現こそ、 神経系が高次な計算を安定に行なうことができる素子レベルの基盤である。
4.9 シナプス伝達による情報処理の例
さて、ここまでシナプスの意義について論じてきた。 しかしシナプスが入力を重み付けして統合しているとだけ聞いても、 果たしてそれで情報を整理・判断しているということになるのか、 疑問であろう。 そこで本節の終わりに、デルコミンの成書からひとつ例を借りてこようとおもう。
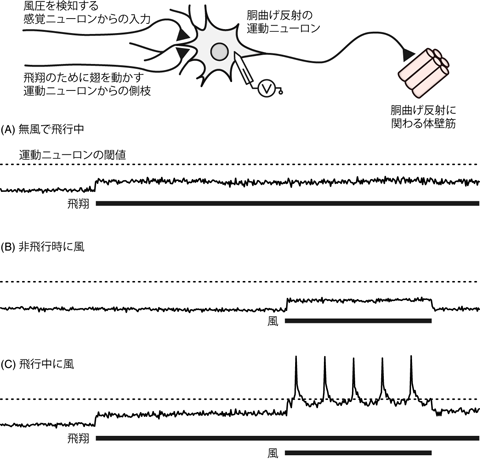
Figure 27はバッタの飛翔中の姿勢維持反射に関わる神経機構を示したものである。 バッタは飛翔中に風を受けると、反射的に胴を曲げて「舵取り」をする。 この反射性筋収縮を制御している運動ニューロンは、 2種類の特徴的な入力をうける。 ひとつは、 「風を受けた」という感覚情報を中枢に伝える感覚ニューロンからの入力である。 この感覚ニューロンは、 知覚のための感覚情報を脳へと伝える傍らで、 胴曲げ反射に関わるニューロンへも分枝を出しているのだ。 もうひとつは、 翅の筋を制御して飛翔するための運動ニューロンからの入力である。 この運動ニューロンの本来の役割は、 飛翔筋をタイミングよく刺激して翅をはばたかせることだ。 しかしその一方で、 飛翔そのものとは無関係な体壁筋の運動ニューロンへも分岐し、 シナプスをつくっている。
このように体壁筋の運動ニューロンは、 それぞれ別の役割をもった2種類のニューロンたちから、 彼らのメインの機能とは一見無関係な分枝を受け取っている。 これら2種類のシナプスはともに興奮性であり、 体壁筋の運動ニューロンにEPSPを発生する。 普通に考えると、 ただ空を飛ぶためだけなら、 飛翔運動に関わるニューロンが、 体壁筋の運動ニューロン(反射のための運動ニューロン)へと側枝を出す必要はない。 彼の役割はあくまで飛翔に必要な翅の筋を制御することであり、 胴を曲げるための運動ニューロンに、 空を飛んでいるあいだずっと出力している必要はないはずだ。 風を受けたら反射的に胴を曲げたいのであれば、 風を受けたかどうかという感覚入力だけが入っていれば十分ではないか。
しかし実際のバッタの神経はそうなってはいない。 Figure 27に戻って考えよう。 さまざまな実験条件において、 胴曲げ運動に関わる運動ニューロンの膜電位を記録したグラフが描かれている。 まず、バッタが無風条件下で飛翔している場合をみてみよう(Figure 27A)。 このとき体壁筋の運動ニューロンは、 飛翔関連ニューロンからのシナプス伝達により少し脱分極している。 しかしこの入力だけではシナプス後ニューロンは閾値に達せず、 活動電位は発生していない。 すなわちこのニューロンは、 ただ飛んでいる際には多少脱分極はするものの、活動電位は生じないわけだ。
次にこのバッタを台上に立たせて風を当てたときの神経活動を見てみよう (Figure 27B)。 このとき体壁筋の運動ニューロンは、 風を受けた感覚を伝えるニューロンからのシナプス入力を受けるため、 やはり少し脱分極している。 しかしこの脱分極も閾値を超えるほどではなく、 体壁筋の運動ニューロンが発火することはない。
しかし飛翔中に風が当たると、様相は一変する(Figure 27C)。 「飛翔中に風が当たる」という状況では、 飛翔運動制御に関わる中枢からの分枝により、 体壁筋の運動ニューロンは少し脱分極した状態になっている。 この状態でバッタに風が当たるとどうなるだろう。 運動ニューロンには風を受けたことによる感覚入力がさらに入ってくることになり、 これがすでに受けていた脱分極性入力と統合される。 すなわち2種のシナプスからの入力がシナプス後ニューロン内で統合され、 より大きな脱分極が生じることになる。 そしてこの大きなシナプス後電位はしばしば閾値を上回り、 運動ニューロンが発火して胴曲げ反射が起こるのだ。
このようにバッタの胴曲げ反射においては、 現在自分が行なっている運動(飛翔)の情報と、 反射のきっかけとなる感覚(風)の情報が統合され、 胴曲のための運動ニューロンの発火を引き起こしている。 これはシナプスでの情報処理によって行動の切り替えが行なわれている典型的な例である。 飛翔・風の一方だけでは運動ニューロンの膜電位は閾値に達せず、 胴曲げ反射は起こらない。 しかしこれらの入力が同時にやってきたときには、PSPの加重によって反射行動が生じるのだ。
もし先に考えたように感覚入力のみによって体壁筋の運動ニューロンが制御されていたらどうなるだろうか。 もうお分かりだろう。 そのような神経回路だけでは、 バッタは地面に立っているときでも、 風を受けると常に胴を曲げて舵取り運動をしてしまう。 そんなことになったら、 そのバッタは、 風が吹いているあいだじゅう体を曲げて過ごさなくてはなってしまう。 風を受けたときに体を曲げて舵取りする必要があるのは、 あくまで飛翔しているときだけなのだ。
このような例から、速度やエネルギーコストの面では非効率的なシナプス伝達が、 じつは重要な役割をもっていることが理解される。 こうした情報処理は、 「1」という情報を「1」としてそのまま伝えるだけの伝導の機構では達成できないものなのだ。 本例ではモデル的な図を使い、統合される入力もたった2つで説明した。 しかし実際のわれわれの神経においては、 何万ものシナプスがひとつのニューロンに結合し、 その膨大な量の情報が加重されているのである。





 @kanri_ninjin
@kanri_ninjin



 イクナイ! 581
イクナイ! 581